А. Д. Чеботарева О. С. Левин
ФГБОУ ДПО РМАНПО Минздрава России
Глобальное увеличение численности пациентов с деменцией в мире и пока безуспешные попытки найти средства, способные замедлить прогрессирование основных заболеваний, вызывающих когнитивное снижение, заставляют более внимательно подходить к возможностям уже применяющихся антидементных средств — с тем, чтобы извлечь из них наибольшую пользу. В силу целого ряда обстоятельств ингибитор центральной ацетилхолинэстеразы донепезил на протяжении последних десятилетий является наиболее часто используемым антидементным препаратом, универсально применяемым как на ранней, так и на поздней стадии болезни Альцгеймера, при сосудистой деменции, деменции с тельцами Леви, болезни Паркинсона с деменцией, хронической травматической энцефалопатии. При умеренной и тяжелой деменции донепезил применяется как в виде монотерапии, так и в комбинации с мемантином. На примере донепезила в статье рассмотрены основные принципы антидементной терапии, возможные предикторы ее эффективности, а также перспективы поисков новых антидементныхъ средств на основе донепезила.
Ключевые слова: донепезил, ингибиторы ацетилхолинэстеразы, деменция, болезнь Альцгеймера, деменция.

По данным ВОЗ, 5–8 % лиц старше 60 лет страдают деменцией. По прогнозу, с 2015 по 2050 г. доля людей старше 60 лет возрастет с 12 до 22 %, соответственно, количество больных деменцией увеличится с 47,5 млн до 135,5 млн [1, 2].
Риск деменции быстро увеличивается с возрастом, однако ее причиной является не само по себе старение (поэтому популярный некогда термин «сенильная деменция» некорректен), а более сотни различных заболеваний головного мозга, многие из которых действительно сцеплены с возрастом. Большая часть случаев деменции во всех странах мира приходится на нейродегенеративные заболевания. Болезнь Альцгеймера служит причиной деменции в 60–70 % случаев, к частым причинам деменции относятся также деменция с тельцами Леви (10–15 %) и лобно-височные дегенерации (5–8 %). Хотя цереброваскулярная патология часто способствует инициации и прогрессированию нейродегенеративных процессов, «чисто» сосудистая патология относительно редко бывает причиной деменции (10–15 %). Сосудистая деменция чаще всего развивается в рамках дисциркуляторной энцефалопатии, реже — вследствие инсульта с поражением зон головного мозга, отвечающих за когнитивные функциии. Значительная часть случаев деменции имеет смешанный характер. Например, болезнь Альцгеймера может сопутствовать сосудистой деменции и/или деменции с тельцами Леви. Три указанных патологических процесса по отдельности или в сочетании составляют около 85 % случаев деменции.
При нозологической диагностике в первую очередь важно исключить потенциально обратимые деменции. Оперативное лечение может привести к стабилизации или улучшению когнитивных функций при нормотензивной гидроцефалии, субдуральной гематоме и опухолях мозга. Нормализация метаболических процессов предотвращает когнитивное снижение при нарушениях функции щитовидной железы, сахарном диабете, дефиците витамина В12. Применение антибиотиков необходимо при нейросифилисе и нейробореллиозе. Иммуносупрессивная терапия проводится при развитии деменции в рамках демиелинизирующих заболеваний, васкулитов и саркоидоза. Токсические деменции, прежде всего алкогольная, также относятся к потенциально обратимым.
Деменция является одной из основных причин инвалидизации лиц пожилого возраста. Приводя к социальной и бытовой дезадаптации, деменция ложится тяжким бременем не только на пациента, его семью, лиц, обеспечивающих уход, но и общество в целом. Уменьшить тяжесть этого бремени способна адекватная антидементная терапия. У значительной части больных она позволяет улучшить, стабилизировать или замедлить прогрессирование когнитивных, нейропсихиатрических и функциональных симптомов дементирующих заболеваний [3, 4].
Вовремя назначенная терапия позволяет улучшить качество жизни пациентов и их близких, улучшает взаимоотношения в семье, дает возможность больным дольше участвовать в жизни общества. Существующие в настоящее время рекомендации по ведению пациентов с деменцией в основном схожи в разных странах мира. В соответствии с принципами доказательной медицины показана эффективность лишь двух классов лекарственных средств: ингибиторов холинэстеразы (ИХЭ) и модулятора NMDA-глутаматных рецепторов мемантина, которые относят к категории базисной терапии деменции.
Понятие базисной терапии включает те методы лечения, которые могут оказывать долгосрочный эффект, в отличие от краткосрочных симптоматических мер, направленных, например, на коррекцию актуальных аффективных и поведенческих нарушений.
Основными задачами базисной терапии являются:
- предупреждение дальнейшего повреждения головного мозга;
- ослабление, долгосрочная стабилизация или замедление нарастания когнитивных нарушений и других психических расстройств.
Предупреждение дальнейшего повреждения головного мозга основывается на этиопатогенетической терапии и возможно при обратимых или частично обратимых деменциях, в том числе при сосудистой деменции. Адекватная коррекция артериальной гипертензии и других сосудистых факторов риска, назначение антиагрегантов или антикоагулянтов способны предупредить развитие дополнительного повреждения мозга и тем самым улучшить долгосрочный прогноз.
Второе направление базисной терапии может осуществляться путем применения как патогенетических, так и симптоматических средств, способствующих улучшению и длительной стабилизации когнитивных функций и функционального статуса пациентов, несмотря на возможное дальнейшее прогрессирование патологического процесса.
Для того чтобы лекарственное средство удовлетворяло требованиям лекарственной терапии, его эффективность должна быть показана в двойных слепых плацебо-контролируемых исследованиях, при этом препарат должен вызывать:
- ослабление, стабилизацию или более медленное нарастание когнитивных расстройств (по сравнению с плацебо) по данным нейропсихологического тестирования;
- улучшение повседневной активности (с точки зрения родственника или ухаживающего лица);
- благоприятное общее впечатление врача и ухаживающего лица;
- долгосрочную эффективность (сохраняющуюся не менее 6 месяцев).
Желательно долгосрочное улучшение качества жизни пациента и его родственников, однако до настоящего времени отсутствуют валидные инструменты оценки качества жизни у пациентов с деменцией.
Именно базисная терапия позволяет решать такие долгосрочные цели лечения деменции, как:
1) максимально длительное поддержание бытовой независимости и отдаление момента развития беспомощности;
2) снижение нагрузки по уходу для родственников и социальных служб;
3) откладывание развития поздних поведенческих нарушений и момента госпитализации в психиатрические учреждения.
Механизм действия мемантина связан с модулированием глутаматергической передачи, которая опосредует кортикокортикальные и кортико-субкортикальные взаимосвязи в головном мозге. В серии контролируемых исследований доказана способность мемантина улучшать и стабилизировать когнитивные функции, повседневную активность, уменьшать поведенческие нарушения у пациентов с болезнью Альцгеймера как на ранней стадии, так и особенно на стадии умеренной и тяжелой деменции. При сосудистой деменции отмечено положительное влияние мемантина на когнитивные функции, а при болезни Паркинсона с деменцией и деменции с тельцами Леви — на нейропсихиатрические и поведенческие симптомы [11].
Теоретическим обоснованием применения ингибиторов холинэстеразы (ИХЭ) является «холинергическая гипотеза», согласно которой когнитивные, поведенческие и функциональные расстройства объясняются (по крайней мере частично) гибелью холинергических нейронов базального ядра Мейнерта и снижением активности холинергических систем в мозге [12]. В настоящее время в клинической практике применяются три ИХЭ: галантамин, ривастигмин и донепезил. Все они рекомендованы при легкой и умеренной болезни Альцгеймера [13, 14]. Донепезил (стандартный препарат 10 мг/сут и препарат с замедленным высвобождением 23 мг/сут) и пластырь с ривастигмином (13,3 мг/сут) могут применяться при тяжелой БА. Метаанализ исследований эффективности сопоставимых доз трех ИХЭ не выявил статистически значимой разницы между ними [18].
Эффективность ИХЭ и мемантина при болезни Альцгеймера доказана в крупных рандомизированных клинических исследованиях [19]. Менее четкий эффект показан при сосудистой деменции, деменции с тельцами Леви и болезни Паркинсона с деменцией [20–22]. Остается открытым вопрос об эффективности антидементной терапии при таких заболеваниях, как болезнь Гентингтона, CADASIL, лобно-височная деменция, прогрессирующий надъядерный паралич.
При отсроченном назначении лечения обычно не удается достичь того же результата, как при раннем начале лечения. В последнем случае состяние временно стабилизируется на более высоком уровне. Данный феномен может косвенно указывать на нейропротективный потенциал препаратов, что установлено в экспериментальных исследованениях, но не удается подтвердить клинически. Сразу после отмены препарата его эффект быстро регрессирует, что указывает на преимущественно симптоматический характер действия [26, 27].
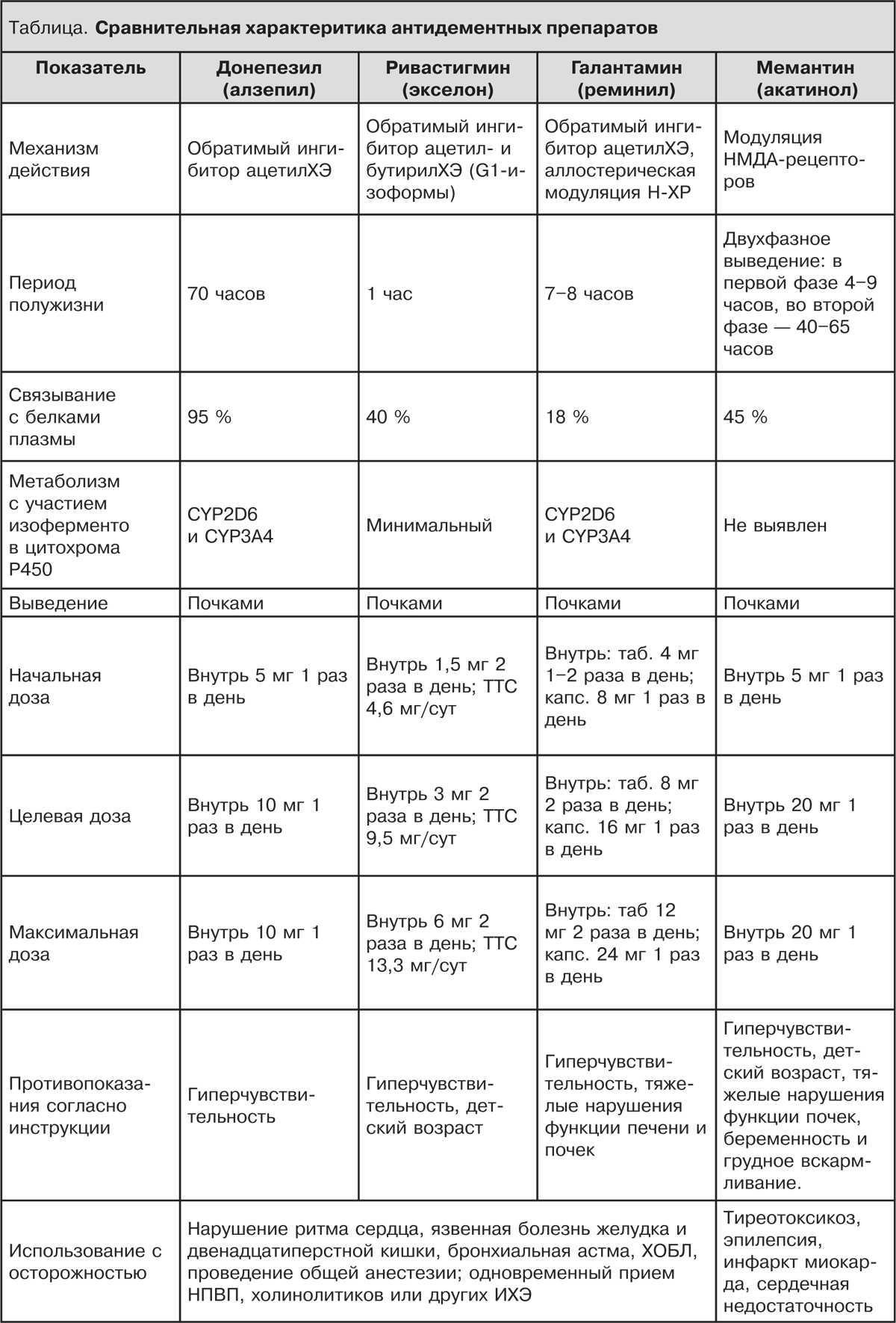
Выбирая антидементный препарат, врач в основном руководствуется степенью выраженности когнитивных нарушений и наличием противопоказаний. При легкой и умеренной деменции по возможности первым назначается один из трех ИХЭ. При тяжелой деменции чаще терапию начинают с мемантина. Метаанализ 76 РКИ показал, что при легкой и умеренной деменции комбинация ИХЭ с мемантином не имеет преимуществ по сравнению с монотерапией ИХЭ. Применение любого из трех ИХЭ превосходит плацебо по влиянию на когнитивные функции и повседневную активность, донепезил и мемантин уменьшают выраженность поведенческих нарушений. Этот же метаанализ не выявил эффективности ИХЭ и мемантина как в форме монотерапии, так и в виде комбинированной терапии при тяжелой деменции [28]. Еще один метаанализ подтвердил эффективность всех трех ИХЭ (галантамина в дозе 24 и 32 мг, донепезила в дозе 10 мг и ТТС с ривастигмином 13,3 мг) и мемантина при легкой и умеренной деменции. При тяжелой деменции эффективной показала себя комбинация 20 мг мемантина с 10 мг донепезила [29, 30]. Сравнительная характеритика антидементных препаратов приведена в таблице.
Донепезил был разработан японской фармацевтической компанией Eisai, клинические исследования были начаты в 1989 г. В 1996 г. донепезил рекомендован FDA к использованию при БА. Донепезил был вторым препаратом (после такрина), официально разрешенным FDA для примененения при БА, и первым препаратом, который в силу более высокой безопасности стал широко применяться при этом заболевании. Хотя вслед за этим были введены в клиническую практику ривастигмин, галантамин и мемантин, донепезил остается самым часто применяемым в мире антидементным препаратом [31, 32].
Проведенные исследования демонстрируют его эффективность при БА, болезни телец Леви, ЧМТ, сосудистой деменции и болезни Паркинсона с деменцией. Помимо непосредственного влияния на когнитивные фукции, есть данные, что донепезил способен позитивно влиять на ходьбу и уменьшает риск падений за счет улучшения внимания [33].
В настоящее время донепезил выпускается в форме таблеток в дозах 5 и 10 мг, которые принимают 1 раз в день. Таблетки более удобны по сравнению с капсулами для пациентов пожилого возраста, а однократный прием улучшает комплаенс. Ведется разработка других лекарственных форм донепезила для трансдермального [34, 35] и интраназального применения [37].
Прием донепезила начинают с 5 мг 1 раз в день, через 4 недели возможно повышение дозы до 10 мг 1 раз в день. В большинстве случаев рекомендуется принимать донепезил вечером в связи с частым развитием тошноты. Пик концентрации в крови достигается через 3–4 часа после приема препарата, вечерний прием позволяет избежать тошноты в дневные часы. Однако донепезил способен вызывать яркие сновидения. Часть пациентов относятся положительно к этому «побочному» эффекту. Но если ночные сновидения вызывают дискомфорт, если пациенты предъявляют жалобы на ночные кошмары, рекомендовано перенести прием донепезила на утро.
Прием пищи не оказывает влияния на всасывание прапарата, биодоступность близка к 100 %. Время полувыведения составляет примерно 70 часов Систематическое применение однократных доз приводит к достижению равновесного состояния в течение 2–3 недель после начала терапии. Связь с белками плазмы — 95 %. В связи с этими характеристиками, если пациент однократно забывает принять препарат, это не оказывает существенного влияния на терапевтический эффект. С другой стороны, длительный период полувыведения, связь с белками плазмы обязывают более ответственно относиться к мониторингу развития побочных эффектов. В случае их развития они регрессируют не сразу после отмены препарата, а спустя несколько дней, что может потребовать дополнительной терапии или более длительного отмывочного периода.
Донепезил легко проникает через гемато-энцефалический барьер. Метаболизируется в печени с участием изоферментов цитохрома Р450 CYP2D6 и CYP3A4, подвергается глюкуронированию. Определены 4 основные метаболита донепезила, два из которых являются ативными. В отличие от такрина, в терапевтических дозах не является гепатотоксичным. Индукторы печеночных ферментов (фенитоин, карбамазепин, фенобарбитал, дексаметазон) могут ускорять, а ингибиторы печеночных ферментов (кетоконазол) замедлять метаболизм донепезила.
Донепезил выводится почками как в неизменном виде (15–20 %), так и в форме многочисленных метаболитов. В качестве противопоказаний в инструкции донепезила фигурирует гиперчувствительность, в том числе к другим производным пиперидина (к ним относятся лобелин, промедол, лоперамид, тригексифенидил), и детский возраст до 18 лет (ввиду отсутствия клинических данных).
Как все препарты с холинергической активностью, донепезил следует с осторожностью применять при нарушении ритма сердца, язвенной болезни желудка и двенадцатиперстной кишки, бронхиальной астме, хронических обструктивных заболеваниях легких, при проведении общей анестезии, одновременном приеме НПВП, холиноблокаторов, других ингибиторов холинэстеразы. По потенциальному тератогенному действию он относится к группе С. Нет данных о возможности применения донепезила в период лактации и у детей.
Наиболее частыми побочными эффектами донепезила являются тошнота и диарея, но они редко служат причиной отмены препарата и, как правило, купируются в течение трех недель даже на фоне продолжения приема препарата. Также донепезил способен вызывать головную боль, головокружение, общую слабость и мышечные крампи.
При назначении лекарственной терапии в гериатрической практике часто не учитывается лекарственное взаимодействие. Полипрогмазия может приводить к неэффективности проводимой антидементной терапии (при наличии в листе назначения таких препаратов, как дифенгидрамин (димедрол), бензодиазепины, антиэпилептические препараты, трициклические антидепрессанты и других препаратов с холинолитическим действием) и повышает риск развития побочных эффектов [38].
Способность удлинять интервал QT, связанная с ваготоническим действием ИХЭ, может быть потенциально опасной у пациентов пожилого возраста [39]. В связи с этим назначение донепезила, как и других ИХЭ, требует мониторинга ЧСС [40]. Риск развития брадикардии возрастает при комбинации ИХЭ с бета-блокаторами, препаратами с холинергическим действием. Есть сообщения о единичных случаях развития таких опасных побочных явлений, как злокачественный нейролептический синдром и рабдомиолиз. Риск их развития повышается при комбинации донепезила с нейролептиками и статинами, способными вызывать эти побочные явления.
Существенной проблемой при лечении деменции является невысокий комплаенс пациентов. С одной стороны, они могут просто забывать принять лекарство. С другой стороны, из-за отсутствия клинического эффекта от каждой принятой таблетки, относительно высокой стоимости антидементных лекарственных препаратов, большого количества уже принимаемых пожилыми пациентами препаратов по поводу соматической патологии, родственники и сами пациенты могут отказаться от проведения терапии.
Невелик «комплаенс» и врачей-неврологов. Считая противодементные препараты малоэффективными и боясь развития побочных эффектов, врачи часто не назначают их при наличии показаний. Нигилистические представления о низкой эффективности противодементных препаратов связаны во многом с трудностью оценки их эффекта. Несмотря на то что показанием для назначения препаратов является наличие деменции, применение этих препаратов нечасто приводит к улучшению показателей шкал для оценки когнитивных функций. Сами пациенты редко отмечают положительный эффект от проводимой терапии, а добавление нового препарата может вызывать чувство тревоги и фобии развития всех тех побочных эффектов, которые перечислены в анотации к препарату. Однако если родственники или ухаживающие лица проживают вместе с пациентом, практически в 100 % случаев они отмечают положительный эффект антидементной терапии. У каждого пациента он может быть свой и чаще связан с улучшением функционального состояния, уменьшением поведенческих и психотических нарушений, нежели с улучшением когнитивных функций. На фоне нарастающего когнитивного дефекта этот эффект может выглядеть «незначительным» для врача, оценивающего клиническую картину в целом. Но он может иметь огромное значение для конкретного пациента и его родственников. Формирование адекватного ожидания от проводимого долгосрочного дорогостоящего лечения — важная составляющая антидементной терапии.
Попытки персонализировать применение базисных антидементных средств предпринимаются уже более 15 лет. Еще в 1999 г. Mega et al. [41] описали в качестве предикторов эффективности ИХЭ поведенческие особенности пациентов с БА. Бред, возбуждение, расторможенность, тревога и раздражительность купировались на фоне приема донепезила, приводя к статистически значимому улучшению показателя нейропсихиатрической шкалы (NPI), тогда как улучшения оценки по MMSE отмечено не было. Эти же авторы позже показали, что у этих пациентов отмечается более низкая перфузия латеральных и дорсолатеральных орбитофронтальных областей головного мозга с двух сторон, что может служить инструментальным критерием для выявления больных с вышеописанными поведенческими нарушениями [42]. При аутопсии именно у этой группы пациентов чаще статистически значимо выявляются нейрофибриллярные клубочки в орбитофронтальной коре с обеих сторон [43].
Pakrasi et al. в качестве предиктора эффективности влияния ИХЭ на MMSE выявили исходно низкий уровень этого показателя. Была отмечена их большая эффективность при наличии галлюцинаций, а также при деменции с тельцами Леви (ДТЛ) и болезни Паркинсона с деменцией (БПД) по сравнению с БА [44–46]. С другой стороны, снижение внимания и выраженная атрофия медиальных отделов височной доли по данным нейровизуализации являются предикторами плохого ответа на ИХЭ [47].
Наиболее изученными кандидатами в генетические предикторы эффективности и безопасности антидементных средств являются гены печеночных цитохромов, аполипопротеина Е и бутирилхолинэстеразы (БХЭ). Носители генотипа APOE-4 и ультрабыстрые метаболизаторы — носители мутантных форм CYP2D6 дают наихудший ответ на проводимое лечение. APOE-4 аллель выявляется более чем у 40 % пациентов с БА [48–50]. В китайском исследовании [51] у носителей генотипов CYP2D6 *1/*10 и *10/*10 по сравнению с генотипом *1/*1 отмечалась большая концентрация донепезила в плазме крови и лучший клинический эффект его применения. K-вариант генотипа БХЭ ассоциирован со сниженной активностью фермента и худшим ответом на лечение ИХЭ, особенно среди носителей АРОE-4 [52–54].
В процессе лечения необходим регулярный контроль эффективности и безопасности применяемых лекарственных средств. Поскольку ИХЭ оказывается эффективным не у всех пациентов с данной нозологической формой, важно адекватно оценивать клинический эффект. В тех случаях, когда зарегистрирован эффект, необходима длительная, часто многолетняя терапия препаратом.
В тех случаях, когда адекватные дозы препарата не принесли необходимого эффекта, его следует заменить либо на другой ИХЭ, либо на препарат с иным механизмом действия. Вариабельность эффекта ИХЭ отражает гетерогенность заболеваний: у пациентов с разными вариантами болезней роль холинергического дефицита может быть различной. Поскольку надежных и универсальных предикторов эффективности ИХЭ до настоящего времени выявить не удалось, всем пациентам, которым показан ИХЭ, следует провести пробную терапию ИХЭ, которая должна продолжаться 6 месяцев.
При оценке эффекта ИХЭ следует учитывать комплексность его действия на различные мишени: когнитивные функции, функциональный статус, аффективные и поведенческие нарушения. В связи с этим еще до назначения препарата следует сформулировать цели лечения и выбрать терапевтические мишени — те клинические проблемы, которые наиболее актуальны у данного пациента и на которые врач в первую очередь планирует воздействовать (когнитивные, функциональные, поведенческие нарушения и т.д.). Необходимо по возможности количественно оценить исходный уровень когнитивных и поведенческих нарушений, состояние функционального статуса, чтобы получить точку отсчета для последующей оценки эффективности препарата.
Контроль эффективности долгосрочной базисной терапии должен проводиться каждые 6 месяцев с помощью нейропсихологического тестирования и оценки функционального статуса. При БА об эффективности препарата может свидетельствовать увеличение, отсутствие снижения оценки по MMSE по MMSE или, в крайнем случае, снижение оценки по этой шкале не более чем на 1 балл (за полгода) либо уменьшение выраженности поведенческих симптомов и улучшение функционального статуса. При СД, как показывают результаты контролируемых исследований, ожидаемый результат должен заключаться в улучшении когнитивного статуса по сравнению с исходным уровнем.
С пациентом и его близкими необходимо подробно обсудить диагноз, прогноз, возможности лечения. Назначая препарат пациентам с БА или сосудистой деменцией, важно подчеркнуть, что не существует препарата или метода лечения, который бы полностью вылечивал заболевание. Необходимо также отметить, что нет препарата, который бы помогал всем пациентам и у данного конкретного пациента ИХЭ может вызвать хороший эффект, но может оказаться и неэффективным и в этом случае будет отменен. Следует объяснить, что ИХЭ не позволяют вылечить болезнь, но создают условия для долговременной стабилизации («замораживания») психического статуса и уровня повседневной активности пациентов при этом заболевании.
Если применение ИХЭ в первые 6 месяцев лечения принесло положительный результат, то, как правило, целесообразен как можно более длительный прием ИХЭ. После улучшения, которое в среднем наблюдается 3–4 месяца, и стабилизации функций, которая в среднем сохраняется около 12 месяцев (у отдельных пациентов — до нескольких лет), у большинства больных, несмотря на продолжение лечения, закономерно наблюдается снижение когнитивных функций, которое, тем не менее, происходит более медленно и плавно, чем в отсутствие лечения [1].
При появлении побочных эффектов возможны пропуск 1–2 доз препарата и снижение дозы до прежнего уровня. На фоне явного нарастания когнитивных нарушений и поведенческой симптоматики, когда препарат кажется неэффективным, возможны следующие меры:
- повысить дозу принимаемого ИХЭ до максимальной;
- переключиться на другой ИХЭ (показано, что примерно у 50 % пациентов переключение ИХЭ приводит к улучшению);
- отменить ИХЭ, назначив вместо него мемантин, либо добавить мемантин к принимаемому ИХЭ, перейдя на комбинированное лечение.
Следует заметить, что иногда неэффективность ИХЭ оказывается лишь кажущейся и пробная отмена препарата приведет к резкому ухудшению состояния. В этом случае необходимо быстрое восстановление терапии, позволяющей восстановить симптоматический эффект. К пробной отмене препарата иногда целесообразно прибегать при быстром ухудшении состояния и кажущейся неэффективности лечения (при этом за больным должен быть установлен тщательный контроль). Вместе с тем важно предостеречь от резкой отмены препарата, особенно если больной принимал его в высокой дозе — это может повлечь резкое ухудшение когнитивных функций и спутанность сознания.
Итак, в настоящее время существуют четыре антидементных препарата, эффективность и безопасность которых показана в РКИ. Для повышения эффективности антидементной терапии актуален персонализированный подход, ведется активный поиск предикторов эффективности и безопасности ИХЭ у конкретного больного.
Ведется поиск и новых антидементных препаратов. Только на основе донепезила разрабатывается более 20 новых лекарственных средств для лечения деменции [55–59].
Литература
1. Левин О.С. Диагностика и лечение деменции в клинической практике. — М.: МЕДпресс-информ, 2010.
2. WHO, Alzheimer’s Disease International, World Alzheimer’s Report 2010.
3. Rothenberg KG, Rajaram R. Advances in Management of Psychosis in Neurodegenerative Diseases // Curr Treat Options Neurol. 2019 Jan 23; 21 (1): 3. doi: 10.1007/s11940-019-0545-6.
4. Cummings J, Lai TJ, Hemrungrojn S, Mohandas E, Yun Kim S, Nair G, Dash A. Role of Donepezil in the Management of Neuropsychiatric Symptoms in Alzheimer’s Disease and Dementia with Lewy Bodies // CNS Neurosci Ther. 2016 Mar; 22 (3): 159–66. doi: 10.1111/cns.12484.
5. Atri A. The Alzheimer’s Disease Clinical Spectrum: Diagnosis and Management // Med Clin North Am. 2019 Mar; 103 (2): 263-293. doi: 10.1016/j.mcna.2018.10.009.
6. Ngo J, Holroyd-Leduc JM. Systematic review of recent dementia practice guidelines // Age Ageing. 2015 Jan; 44 (1): 25–33. doi: 10.1093/ageing/afu143.
7. Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D, Ballard C, Banerjee S, Burns A, Cohen-Mansfield J, Cooper C, Fox N, Gitlin LN, Howard R, Kales HC, Larson EB, Ritchie K, Rockwood K, Sampson EL, Samus Q, Schneider LS, Selbæk G, Teri L, Mukadam N. Dementia prevention, intervention, and care // Lancet. 2017 Dec 16; 390 (10113): 2673–2734. doi: 10.1016/S0140-6736 (17)31363-6.
8. National Institute for Health and Care Excellence. Dementia: assessment, management and support for people living with dementia and their carers (NG97). NICE, UK, June 20, 2018.
9. Schmidt R., Hofer E., Bouwman F.H., et al. EFNS-ENS/EAN guideline on concomitant use of cholinesterase inhibitors and memantine in moderate to severe Alzheimer’s disease // Eur J Neurol, 2015; 22 (6).
10. Gauthier S., Patterson C., Chertkow H. et al. Recommendations of the 4th Canadian Consensus Conference on the Diagnosis and Treatment of Dementia (CCCDTD4) // Can Geriatr J 2012 15 (4).
11. Qaseem A, Snow V, Cross JT, Jr, et al. Current pharmacologic treatment of dementia: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians // Ann Intern Med. 2008; 148: 370–378. doi: 10.7326/0003-4819-148-5-200803040-00008.
12. Furey ML. The prominent role of stimulus processing: cholinergic function and dysfunction in cognition // Curr Opin Neurol. 2011 Aug; 24 (4): 364–70. doi: 10.1097/WCO.0b013e328348bda5.
13. Birks J. Cholinesterase inhibitors for Alzheimer’s disease // Cochrane Database Syst Rev. 2006 Jan 25; (1): CD005593. doi: 10.1055/s-2006-956993.
14. Raina P, Santaguida P, Ismaila A, et al. Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline // Ann Intern Med. 2008; 148: 379–397. doi: 10.7326/0003-4819-148-5-200803040-00009.
15. Farlow MR, Salloway S, Tariot PN, Yardley J, Moline ML, Wang Q, Brand-Schieber E, Zou H, Hsu T, Satlin A. Effectiveness and tolerability of high-dose (23 mg/d) versus standard-dose (10 mg/d) donepezil in moderate to severe Alzheimer’s disease: A 24-week, randomized, double-blind study // Clin Ther. 2010 Jul; 32 (7): 1234–51. doi: 10.1016/j.clinthera.2010.06.019.
16. Cummings J, Froelich L, Black SE, Bakchine S, Bellelli G, Molinuevo JL, Kressig RW, Downs P, Caputo A, Strohmaier C. Randomized, double-blind, parallel-group, 48-week study for efficacy and safety of a higher-dose rivastigmine patch (15 vs. 10 cm²) in Alzheimer’s disease // Dement Geriatr Cogn Disord. 2012; 33 (5): 341–53. doi: 10.1159/000340056.
17. Farlow MR, Grossberg GT, Sadowsky CH, Meng X, Somogyi M. A 24-week, randomized, controlled trial of rivastigmine patch 13.3 mg/24 h versus 4.6 mg/24 h in severe Alzheimer’s dementia // CNS Neurosci Ther. 2013 Oct; 19 (10): 745–52. doi: 10.1111/cns.12158.
18. Takeda A, Loveman E, Clegg A, Kirby J, Picot J, Payne E, Green C. A systematic review of the clinical effectiveness of donepezil, rivastigmine and galantamine on cognition, quality of life and adverse events in Alzheimer’s disease // Int J Geriatr Psychiatry. 2006 Jan; 21 (1): 17–28. doi: 10.1002/gps.1402.
19. Tricco AC, Ashoor HM, Soobiah C, Rios P, Veroniki AA, Hamid JS, Ivory JD, Khan PA, Yazdi F, Ghassemi M, Blondal E, Ho JM, Ng CH, Hemmelgarn B, Majumdar SR, Perrier L, Straus SE. Comparative Effectiveness and Safety of Cognitive Enhancers for Treating Alzheimer’s Disease: Systematic Review and Network Metaanalysis // J Am Geriatr Soc. 2018 Jan; 66 (1): 170–178. doi: 10.1111/jgs.15069.
20. Jin BR, Liu HY. Comparative efficacy and safety of cognitive enhancers for treating vascular cognitive impairment: systematic review and Bayesian network meta-analysis // Neural Regen Res. 2019 May; 14 (5): 805–816. doi: 10.4103/1673-5374.249228.
21. Hershey LA, Coleman-Jackson R. Pharmacological Management of Dementia with Lewy Bodies // Drugs Aging. 2019 Jan 25. doi: 10.1007/s40266-018-00636-7.
22. Dubois B, Tolosa E, Katzenschlager R, Emre M, Lees AJ, Schumann G, Pourcher E, Gray J, Thomas G, Swartz J, Hsu T, Moline ML. Donepezil in Parkinson's disease dementia: a randomized, double-blind efficacy and safety study // Mov. Disord. 2012 Sep 01; 27 (10): 1230–8.
23. Farlow M. A clinical overview of cholinesterase inhibitors in Alzheimer’s disease // Int Psychogeriatr. 2002; 14 Suppl 1: 93–126. doi: 10.1017/S1041610203008688.
24. Small G, Erkinjuntti T, Kurz A, Lilienfeld S. Galantamine in the treatment of cognitive decline in patients with vascular dementia or Alzheimer’s disease with cerebrovascular disease // CNS Drugs. 2003; 17 (12): 905–14. doi: 10.2165/00023210-200317120-00004.
25. Doraiswamy PM, Krishnan KR, Anand R, Sohn H, Danyluk J, Hartman RD, Veach J. Long-term effects of rivastigmine in moderately severe Alzheimer’s disease: does early initiation of therapy offer sustained benefits? // Prog Neuropsychopharmacol Biol Psychiatry. 2002 May; 26 (4): 705–12. doi: 10.1016/s0278-5846 (01)00326-8.
26. Magierski R, Sobow T. Benefits and risks of add-on therapies for Alzheimer’s disease // Neurodegener Dis Manag. 2015 Oct; 5 (5): 445–62. doi: 10.2217/nmt.15.39.
27. Lemstra AW, Richard E, van Gool WA. Cholinesterase inhibitors in dementia: yes, no, or maybe? Age Ageing. 2007 Nov; 36 (6): 625–7. doi: 10.1093/ageing/afm117.
28. Tsoi KK, Chan JY, Chan FC, Hirai HW, Kwok TC, Wong SY. Monotherapy Is Good Enough for Patients with Mild-to-Moderate Alzheimer’s Disease: A Network Meta-analysis of 76 Randomized Controlled Trials // Clin Pharmacol Ther. 2019 Jan; 105 (1): 121–130. doi: 10.1002/cpt.1104.
29. Dou KX, Tan MS, Tan CC, Cao XP, Hou XH, Guo QH, Tan L, Mok V, Yu JT. Comparative safety and effectiveness of cholinesterase inhibitors and memantine for Alzheimer’s disease: a
network meta-analysis of 41 randomized controlled trials // Alzheimers Res Ther. 2018 Dec 27; 10 (1): 126. doi: 10.1186/s13195-018-0457-9.
30. Matsunaga S, Kishi T, Nomura I, Sakuma K, Okuya M, Ikuta T, Iwata N. The efficacy and safety of memantine for the treatment of Alzheimer’s disease // Expert Opin Drug Saf. 2018 Oct; 17 (10): 1053–1061. doi: 10.1080/14740338.2018.1524870.
31. Brewster JT 2nd, Dell’Acqua S, Thach DQ, Sessler JL. Classics in Chemical Neuroscience: Donepezil // ACS Chem Neurosci. 2018 Nov 8. doi: 10.1021/acschemneuro.8b00517.
32. Kumar A, Sharma S. Donepezil. 2018 Dec 18. Treasure Island (FL): StatPearls.
33. Montero-Odasso M, Speechley M, Chertkow H, Sarquis-Adamson Y, Wells J, Borrie M, Vanderhaeghe L, Zou GY, Fraser S, Bherer L, Muir-Hunter SW. Donepezil for gait and falls in mild cognitive impairment: a randomized controlled trial // Eur J Neurol. 2018 Nov 22. doi: 10.1111/ene.13872.
34. Mendes IT, Ruela ALM, Carvalho FC, Freitas JTJ, Bonfilio R, Pereira GR. Development and characterization of nanostructured lipid carrier-based gels for the transdermal delivery of donepezil // Colloids Surf B Biointerfaces. 2019 Feb 6; 177: 274–281. doi: 10.1016/j.colsurfb.2019.02.007.
35. AnjiReddy K, Karpagam S. Hyperbranched cellulose polyester of oral thin film and nanofiber for rapid release of donepezil; preparation and in vivo evaluation // Int J Biol Macromol. 2019 Mar 1; 124: 871–887. doi: 10.1016/j.ijbiomac.2018.11.224.
36. Espinoza LC, Silva-Abreu M, Clares B, Rodriguez-Lagunas MJ, Halbaut L, Canas MA, Calpena AC. Formulation Strategies to Improve Nose-to-Brain Delivery of Donepezil. Pharmaceutics. 2019 Feb 1; 11 (2).
37. Patil RP, Pawara DD, Gudewar CS, Tekade AR. Nanostructured cubosomes in an in situ nasal gel system: an alternative approach for the controlled delivery of donepezil HCl to brain // J Liposome Res. 2018 Dec 2: 1–10. doi: 10.1080/08982104.2018.1552703.
38. Campbell NL, Skaar TC, Perkins AJ, Gao S, Li L, Khan BA, Boustani MA. Characterization of hepatic enzyme activity in older adults with dementia: potential impact on personalizing pharmacotherapy // Clin Interv Aging. 2015 Jan 14; 10: 269–275. doi: 10.2147/cia.s65980.
39. Jackson EG, Stowe S. Lesson of the month 1: Prolonged QT syndrome due to donepezil: a reversible cause of falls? // Clin Med (Lond). 2019 Jan; 19 (1): 80–81. doi: 10.7861/clinmedicine.19-1-80.
40. Pu Z, Xu W, Lin Y, Shen J, Sun Y. Donepezil decreases heart rate in elderly patients with Alzheimer’s disease // Int J Clin Pharmacol Ther. 2019 Feb; 57 (2): 94–100. doi: 10.5414/CP203257.
41. Mega MS, Masterman DM, O’Connor SM, Barclay TR, Cummings JL. The spectrum of behavioral responses to cholinesterase inhibitor therapy in Alzheimer disease // Arch Neurol. 1999 Nov; 56 (11): 1388–93. doi: 10.1001/archneur.56.11.1388.
42. Mega MS, Dinov ID, Lee L, O’Connor SM, Masterman DM, Wilen B, Mishkin F, Toga AW, Cummings JL. Orbital and dorsolateral frontal perfusion defect associated with behavioral response to cholinesterase inhibitor therapy in Alzheimer’s disease // J Neuropsychiatry Clin Neurosci. 2000 Spring; 12 (2): 209–18. doi: 10.1176/jnp.12.2.209.
43. Tekin S, Mega MS, Masterman DM, Chow T, Garakian J, Vinters HV, Cummings JL. Orbitofrontal and anterior cingulate cortex neurofibrillary tangle burden is associated with agitation in Alzheimer disease // Ann Neurol. 2001 Mar; 49 (3): 355–61. doi: 10.1002/ana.72.abs.
44. Pakrasi S, Mukaetova-Ladinska EB, McKeith IG, O’Brien JT. Clinical predictors of response to Acetyl Cholinesterase Inhibitors: experience from routine clinical use in Newcastle // Int J Geriatr Psychiatry. 2003 Oct; 18 (10): 879–86. doi: 10.1002/gps.928.
45. McKeith IG, Wesnes KA, Perry E, Ferrara R. Hallucinations predict attentional improvements with rivastigmine in dementia with lewy bodies // Dement Geriatr Cogn Disord. 2004; 18 (1): 94–100. doi: 10.1159/000077816.
46. Van Der Putt R, Dineen C, Janes D, Series H, McShane R. Effectiveness of acetylcholinesterase inhibitors: diagnosis and severity as predictors of response in routine practice // Int J Geriatr Psychiatry. 2006 Aug; 21 (8): 755–60. doi: 10.1002/gps.1557.
47. Connelly PJ, Prentice NP, Fowler KG. Predicting the outcome of cholinesterase inhibitor treatment in Alzheimer’s disease // J Neurol Neurosurg Psychiatry. 2005 Mar; 76 (3): 320–4. doi: 10.1136/jnnp.2004.043539.
48. Cacabelos R, Alvarez A, Fenández-Novoa L, Lombardi VR. A pharmacogenomic approach to Alzheimer’s disease // Acta Neurol Scand Suppl. 2000; 176: 12–9. doi: 10.1034/j.1600-0404.2000.00302.x.
49. Cacabelos R, Torrellas C, Teijido O, Carril JC. Pharmacogenetic considerations in the treatment of Alzheimer’s disease // Pharmacogenomics. 2016 Jun; 17 (9): 1041–74. doi: 10.2217/pgs-2016-0031.
50. Braga IL, Silva PN, Furuya TK, Santos LC, Pires BC, Mazzotti DR, Bertolucci PH, Cendoroglo MS, Smith MC. Effect of APOE and CHRNA7 genotypes on the cognitive response to cholinesterase inhibitor treatment at different stages of Alzheimer’s disease // Am J Alzheimers Dis Other Demen. 2015 Mar; 30 (2): 139–44. doi: 10.1177/1533317514539540.
51. Zhong Y, Zheng X, Miao Y, Wan L, Yan H, Wang B. Effect of CYP2D6*10 and APOE polymorphisms on the efficacy of donepezil in patients with Alzheimer’s disease // Am J Med Sci. 2013 Mar; 345 (3): 222–6. doi: 10.1097/maj.0b013e318255a8f9.
52. Blesa R, Bullock R, He Y, Bergman H, Gambina G, Meyer J, Rapatz G, Nagel J, Lane R. Effect of butyrylcholinesterase genotype on the response to rivastigmine or donepezil in younger patients with Alzheimer’s disease // Pharmacogenet Genomics. 2006 Nov; 16 (11): 771–4. doi: 10.1097/01.fpc.0000220573.05714.ac.
53. Patterson CE, Todd SA, Passmore AP. Effect of apolipoprotein E and butyrylcholinesterase genotypes on cognitive response to cholinesterase inhibitor treatment at different stages of Alzheimer’s disease // Pharmacogenomics J. 2011 Dec; 11 (6): 444–50. doi: 10.1038/tpj.2010.61.
54. Han HJ, Kwon JC, Kim JE, Kim SG, Park JM, Park KW, Park KC, Park KH, Moon SY, Seo SW, Choi SH, Cho SJ. Effect of rivastigmine or memantine add-on therapy is affected by butyrylcholinesterase genotype in patients with probable Alzheimer’s disease // Eur Neurol. 2015; 73 (1-2): 23–8. doi: 10.1159/000366198.
55. Du HT, Liu X, Xie J, Ma F. Novel deoxyvasicinone-donepezil hybrids as potential multitarget drug candidates for Alzheimer’s disease // ACS Chem Neurosci. 2019 Feb 5. doi: 10.1021/acschemneuro.8b00699.
56. Pachоn-Angona I, Refouvelet B, Andrýs R, Martin H, Luzet V, Iriepa I, Moraleda I, Diez-Iriepa D, Oset-Gasque MJ, Marco-Contelles J, Musilek K, Ismaili L. Donepezil + chromone + melatonin hybrids as promising agents for Alzheimer’s disease therapy // J Enzyme Inhib Med Chem. 2019 Dec; 34 (1): 479–489. doi: 10.1080/14756366.2018.1545766.
57. Green KD, Fosso MY, Garneau-Tsodikova S. Multifunctional Donepezil Analogues as Cholinesterase and BACE1 Inhibitors // Molecules. 2018 Dec 8; 23 (12). pii: E3252. doi: 10.3390/molecules23123252.
58. Li Q, He S, Chen Y, Feng F, Qu W, Sun H. Donepezil-based multi-functional cholinesterase inhibitors for treatment of Alzheimer’s disease // Eur J Med Chem. 2018 Oct 5; 158: 463–477. doi: 10.1016/j.ejmech.2018.09.031.
59. Piemontese L, Tomаs D, Hiremathad A, Capriati V, Candeias E, Cardoso SM, Chaves S, Santos MA. Donepezil structure-based hybrids as potential multifunctional anti-Alzheimer’s drug candidates // J Enzyme Inhib Med Chem. 2018 Dec; 33 (1): 1212–1224. doi: 10.1080/14756366.2018.1491564.