
Актуальность и цели: В 2016 году антитела к GFAP (анти-GFAP-IgG) были идентифицированы в качестве маркера подострого менингоэнцефалита с характерной МРТ-картиной — периваскулярного радиального накопления контрастного вещества (КВ), заболевание было названо аутоиммунная GFAP-астроцитопатия (A-GFAP-A). Ассоциация обнаружения анти-GFAP-IgG в цереброспинальной жидкости (ЦСЖ) с подострой формой менингоэнцефалита была воспроизведена в нескольких других исследованиях. Однако анти-GFAP-IgG также выявляются в крови (но не в ЦСЖ) при других аутоиммунных энцефалитах (АЭ) и демиелинизирующих заболеваниях, значение этого феномена не ясно. Целью исследования был анализ экспрессии анти-GFAP-IgG у пациентов с АЭ, атипичными демиелинизирующими заболеваниями (АД), болезнью Альцгеймера (БА), а также сравнение двух методов для определения анти-GFAP-IgG: иммуноферментного анализа (ИФА) и непрямой реакции иммунофлуоресценции (нРИФ).
Материалы и методы. Основную группу составил 41 пациент с АЭ. Группу сравнения-1 (АД) составили 22 пациента с диагнозами: серонегативное заболевание спектра оптиконевромиелита (ЗСОНМ) (n = 2), MOG-ассоциированное заболевание (n = 9), псевдотуморозный вариант рассеянного склероза (РС) (n = 5), ОРЭМ (n = 2), АД (n = 4). Группу сравнения-2 — 16 пациентов с БА; группу контроля-1 (для анализа крови) — 10 здоровых добровольцев; группу контроля-2 (для анализа ЦСЖ) — 18 неврологически здоровых добровольцев с урологической хирургической патологией. У участников исследования выполнялся анализ анти-GFAP-IgG в крови и в ЦСЖ с помощью нРИФ с использованием наборов Euroimmun (Германия) и с помощью ИФА с использованием наборов Cloud Clone Corparation (Китай).
Результаты. Анти-GFAP-IgG методом нРИФ в ЦСЖ были положительными у двух пациентов из группы АЭ — с клинической и нейровизуализационной картиной, характерной для A-GFAP-A (рис. 1), что позволило диагностировать данное заболевание впервые в России. У одного из этих больных анти-GFAP-IgG также были выявлены и в крови. Ранее пациенты наблюдались с диагнозами РС и васкулит ЦНС с поражением мелких сосудов. У остальных пациентов основной группы, групп сравнения и контроля нРИФ анти-GFAP-IgG в ЦСЖ показала отрицательный результат.
Анти-GFAP-IgG в крови (нРИФ) в качестве сопутствующих антител были обнаружены у 9 пациентов с АЭ: анти-NMDAR (n = 2), анти-LGl1 (n = 1), анти-GAD65 (n = 1), анти-Yo-1,Ri, амфифизин (n = 1), АЭ с ядрышковым нейрональным типом свечения неустановленного антитела (n = 1), серонегативный АЭ (n = 3). В группе АД анти-GFAP-IgG в крови были выявлены у 6 больных: псевдотуморозный РС (n = 2), серонегативное ЗСОНМ (n = 1), анти-MOG энцефалит (n = 1), АД (n = 2). Тестирование анти-GFAP-IgG в крови в группах БА и контроля было отрицательным. У половины пациентов с АД и положительными анти-GFAP-IgG в клинической картине был оптический неврит. Других корреляций между наличием анти-GFAP-IgG в крови и клиническими характеристиками не выявлено.
Сравнение уровней анти-GFAP-IgG (ИФА) у пациентов с положительным и отрицательным результатом тестирования анти-GFAP-IgG методом нРИФ продемонстрировало значимую корреляцию высоких и низких уровней анти-GFAP-IgG с наличием и отсутствием анти-GFAP-IgG по результатам нРИФ, соответственно. Данная корреляция была получена при сравнении «положительных» и «отрицательных» пациентов как внутри групп АЭ и АД, так и для всех участников исследования (р < 0,001) (табл. 1, рис. 2).
Для определения уровня анти-GFAP-IgG в крови (ИФА), соответствующего положительному результату анти-GFAP-IgG (нРИФ), выполнен ROC-анализ. 100 % чувствительность и специфичность для обнаружения анти-GFAP-IgG в крови методом ИФА была достигнута при пороге отсечения ≥ 20,75 нг/мл для пациентов с положительными анти-GFAP-IgG по данным нРИФ (AUC = 1, p < 0,001).
Выводы
• Отсутствие обнаружения анти-GFAP-IgG в ЦСЖ у всех пациентов (с АЭ, АД, БА), кроме двух случаев А-GFAP-А, вносит вклад в подтверждение специфичности GFAP-серопозитивности ЦСЖ для диагностирования А-GFAP-А.
• Сывороточные анти-GFAP-IgG могут служить неспецифичным маркером иммуноопосредованного генеза заболевания, что актуально в сложных диагностических случаях (серонегативные АЭ и ЗСОНМ).
• ИФА потенциально может применяться для обнаружения анти-GFAP-IgG в крови наряду с нРИФ, что требует подтверждения в крупных исследованиях.
• Необходимо внедрить в практическую работу тестирование анти-GFAP-IgG в ЦСЖ пациентам: с периваскулярным паттерном накопления КВ по данным МРТ, с предполагаемым диагнозом васкулита ЦНС с поражением мелких сосудов и с предполагаемым диагнозом РС с такими проявлениями как: гриппоподобный продромальный синдром, общемозговая, психиатрическая симптоматика в дебюте.

Рис. 1. МРТ пациентов с А-GFAP-A
А – МРТ пациента-1: а (T2) – множественные, местами сливные очаги повышенной интенсивности МР-сигнала в глубоких отделах белого вещества, в мосту, продолговатом мозге, средних ножках мозжечка; б (Т2-STIR) – множественные с нечеткими контурами очаги в спинном мозге на всем протяжении; в (Т1-С1+) – точечное неоднородное накопление КВ интрамедуллярно на всем протяжении; г-е (Т1-С1+) – линейное периваскулярное накопление КВ в белом веществе полушарий, радиально боковым желудочкам, а также в стволе, ножках мозга, мозжечке.
Б – МРТ пациента-2: а (T2), б, в (Т2-FLAIR) – диффузные симметричные гиперинтенсивные зоны c линейной исчерченностью пониженной интенсивности в глубоких и субкортикальных отделах белого вещества полушарий, наружных капсулах, в проекции зубчатых ядер; г-е (Т1-С1+) – линейный периваскулярный паттерн накопления КВ в белом веществе полушарий, подкорковых структурах, мосту, продолговатом мозге, полушариях мозжечка, в средних мозжечковых ножках.
Табл. 1. Сравнение уровней анти-GFAP-IgG в сыворотке крови, полученных методом ИФА, у подгрупп с положительным и отрицательным результатом анализа анти-GFAP-IgG, полученным методом нРИФ, у исследуемых групп пациентов и контрольной группы
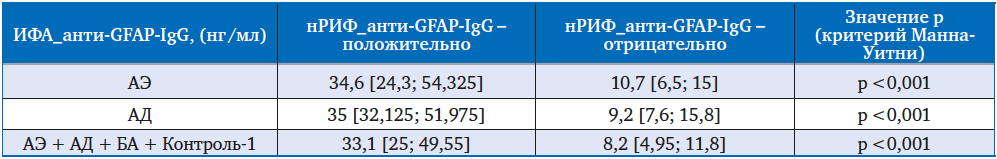

Рис. 2. Уровни анти-GFAP-IgG (ИФА) в подгруппах с положительным и отрицательным результатом анти-GFAP-IgG (нРИФ) у пациентов с АЭ, АД и у всех участников исследования